Cách tính công thức phân tử trong những kỹ năng quan trọng nhất trong hóa học là tính toán các công thức phân tử. Hiểu rõ cách tính này giúp bạn có cái nhìn sâu sắc hơn về cấu trúc của các chất hợp nhất và giúp bạn nghiên cứu, thí nghiệm và ứng dụng nó trong nhiều lĩnh vực .
1. Các bước tính công thức phân tử
Trước tiên, bạn phải thực hiện một số bước cơ bản để xác định thành phần và tỷ lệ các nguyên tố hợp nhất trong chất trước khi bạn có thể tính toán công thức phân tử. Đây là những bước cụ thể mà bạn phải thực hiện.
Xác định khối lượng mol của hợp chất
- Khi tính toán công thức phân tử , một số quan trọng là khối lượng mol. Khối lượng của một chất chính là tổng khối lượng của tất cả các cấu hình nguyên tố thành nó .
- Bạn có thể tìm khối lượng mol của từng nguyên tố bằng cách xem hoàn thành bảng tuần . Khối lượng mol của các nguyên tố được cộng lại để lấy khối lượng mol của toàn bộ chất .
Tính tỉ lệ nguyên tố
- Sau khi biết khối lượng mol của chất hợp nhất , bước tiếp theo là tính toán chính xác giữa các thành phần trong hợp chất. Khối lượng mol của từng nguyên tố phải được chia cho khối lượng mol của toàn bộ chất .
- Khi chia xong , bạn sẽ có tỷ lệ từng thành phần . Để viết công thức phân tử, bạn có thể dễ dàng sử dụng tỷ lệ nguyên tố hợp nhất bằng cách sử dụng tỷ lệ này .
Viết công thức phân tử
- Sau khi có tỷ lệ nguyên tố, bước cuối cùng là viết công thức phân tử. Công thức phân tử sẽ có dạng CxHyOz, trong đó các số nguyên x, y và z thể hiện số nguyên tử của các nguyên tố trong công thức.
- Vì nó thể hiện chính xác cấu trúc hóa học của hợp chất, công thức này không chỉ đơn giản mà còn rất mạnh mẽ..
2. Ví dụ minh họa cách tính công thức phân tử
Cách tính công thức phân tử chúng ta sẽ xem xét một ví dụ cụ thể để hiểu rõ hơn về cách tính toán công thức phân tử.
Hợp chất nước (H2O)
Công thức phân tử của nước dễ tính được vì nó là một hợp chất quen thuộc. Đầu tiên, chúng tôi tìm khối lượng mol nước :
- Hydrogen (H): 1 g/mol
- Oxygen (O): 16 g/mol
Vậy khối lượng mol của nước sẽ là:
- [ (2 \times 1) + (1 \times 16) = 18 \, g/mol ]
- Tiếp theo, chúng ta tính tỷ lệ của các nguyên tố trong nước.
- Tỷ lệ của hydrogen là:
- [ \frac ]
- Tỷ lệ của oxygen là:
- [ \frac ]
- Cuối cùng, từ các tỷ lệ trên, chúng ta có thể viết công thức phân tử của nước là H2O.
Hợp chất glucose (C6H12O6)
Cách tính công thức phân tử một loại đường quan trọng trong sinh học là glucose. Để tính công thức phân tử của glucose, chúng ta sẽ thực hiện các bước tương tự như với nước.
Sau đây là cách tính toán khối lượng mol của glucose:
- Carbon (C): 12 g/mol
- Hydrogen (H): 1 g/mol
- Oxygen (O): 16 g/mol
Khối lượng mol của glucose là:
- [ (6 \times 12) + (12 \times 1) + (6 \times 16) = 180 \, g/mol ]
- Tương tự, chúng ta tính tỷ lệ nguyên tố:
- Tỷ lệ của carbon là:
- [ \frac ]
- Tỷ lệ của hydrogen là:
- [ \frac ]
- Tỷ lệ của oxygen là:
- [ \frac ]
- Cuối cùng, công thức phân tử của glucose là C6H12O6.
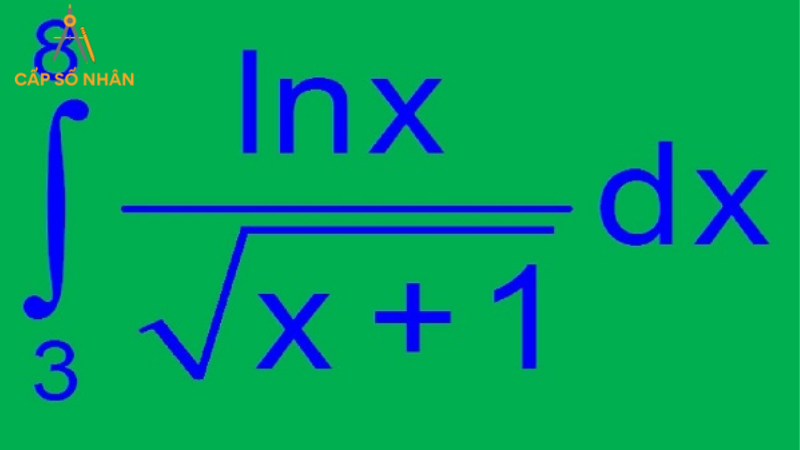
3. Công thức hóa học và công thức phân tử
Cách tính công thức phân tử mặc dù công thức phân tử và công thức hóa học khác nhau, nhưng cả hai đều là những khái niệm quan trọng trong hóa học.
Công thức hóa học
- Công thức hóa học mô tả các thành phần hóa học của một hợp chất. Nó thường chỉ hiển thị các thành phần của một hợp chất và số lượng của chúng. Công thức hóa học không cung cấp thông tin về cấu trúc hoặc cách các nguyên tử được sắp xếp trong các molecule.
- Một ví dụ là công thức hóa học của nước là H2O, cho thấy nó có hai nguyên tử hydro và một nguyên tử oxy.
Công thức phân tử
- Công thức phân tử, ngược lại, cung cấp chi tiết hơn về loại và số lượng nguyên tử trong mỗi phân tử của một hợp chất cụ thể. Công thức phân tử không chỉ mô tả tất cả các nguyên tố có mặt mà còn cho biết chính xác số lượng của mỗi nguyên tố.
- Chẳng hạn, công thức phân tử của glucose là C6H12O6 cho thấy nó gồm 6 nguyên tử carbon, 12 nguyên tử hydro và 6 nguyên tử oxy.
Phân biệt công thức hóa học và công thức phân tử
- Công thức hóa học và phân tử khác nhau về mức độ chi tiết mà chúng cung cấp. Trái ngược với công thức phân tử, công thức hóa học chỉ bao gồm thành phần của hợp chất, trong khi công thức hóa học bao gồm toàn bộ thông tin về cấu trúc của phân tử.
- Trong nghiên cứu hóa học, điều này rất quan trọng vì việc hiểu cách thức các nguyên tử liên kết với nhau ảnh hưởng đến tính chất và hành vi của một hợp chất.
4. Tại sao cần biết cách tính công thức phân tử?
Biết cách tính công thức phân tử có nhiều lợi ích trong học tập và nghiên cứu hóa học cũng như trong cuộc sống hàng ngày.
Ứng dụng trong nghiên cứu khoa học
- Nghiên cứu khoa học đòi hỏi phải biết cách tính công thức phân tử. Nó giúp các nhà nghiên cứu hiểu cấu trúc của các hợp chất mới, giúp họ hiểu rõ hơn về tính chất và tác động của chúng.
- Chẳng hạn, để phát triển thuốc, các nhà khoa học phải biết chính xác công thức phân tử của các hợp chất đang được nghiên cứu để đảm bảo rằng thuốc sẽ hiệu quả và an toàn đối với người sử dụng.
Ứng dụng trong sản xuất công nghiệp
- Công thức phân tử trong sản xuất công nghiệp, đặc biệt là trong ngành hóa chất và dược phẩm, quyết định quy trình sản xuất và chất lượng sản phẩm.
- Biết cách tính công thức phân tử giúp các kỹ sư và chuyên gia trong ngành tối ưu hóa các quy trình và thông số để tạo ra sản phẩm tốt nhất có thể.
Ứng dụng trong đời sống hàng ngày
- Hiểu biết về các công thức phân tử cũng ảnh hưởng đến cách con người đưa ra các quyết định hàng ngày.
- Sự hiểu biết về các công thức phân tử giúp bạn lựa chọn những sản phẩm tốt nhất cho sức khỏe của mình, từ việc lựa chọn thực phẩm và đồ uống cho đến việc mua sắm các sản phẩm sức khỏe.

5. Sự khác biệt giữa công thức phân tử và công thức thực nghiệm
Khi nghiên cứu hóa học, một yếu tố quan trọng mà bạn phải nhận thức được là sự khác biệt giữa các công thức thực nghiệm và phân tử.
Công thức thực nghiệm
- Công thức thực nghiệm không thể hiện số lượng cụ thể của các nguyên tố trong hợp chất mà chỉ thể hiện tỷ lệ tối thiểu của chúng. Điều này cho thấy công thức thực nghiệm chỉ hiển thị tỷ lệ các nguyên tố trong hợp chất bằng số lượng nguyên tố nhỏ nhất.
- Ví dụ, công thức thực nghiệm của glucose là CH2O, cho thấy tỷ lệ giữa carbon, hydro và oxy trong glucose là 1:2:1. Tuy nhiên, công thức thực nghiệm này không cung cấp thông tin chính xác về số lượng từng thành phần trong phân tử glucose.
Công thức phân tử
- Tuy nhiên, công thức phân tử chính xác cho biết số lượng nguyên tử của mỗi nguyên tố trong một phân tử.
- Về ví dụ về glucose, công thức phân tử của nó là C6H12O6, cho thấy nó có 6 nguyên tử carbon, 12 nguyên tử hydro và 6 nguyên tử không khí.
So sánh công thức thực nghiệm và công thức phân tử
- Công thức phân tử và thực nghiệm khác nhau về độ chính xác và chi tiết. Công thức phân tử cung cấp thông tin chính xác hơn về cấu trúc của hợp chất, nhưng công thức thực nghiệm khá đơn giản và không đầy đủ.
- Hiểu rõ sự khác biệt này sẽ giúp bạn áp dụng các công thức đúng đắn trong nghiên cứu hóa học và trong các tình huống thực tế.
6. Phương pháp tính công thức phân tử từ khối lượng mol
Cách tính công thức phân tử một cách phổ biến để tìm công thức phân tử của một hợp chất là sử dụng phương pháp tính công thức phân tử từ khối lượng mol.
Bước 1: Tìm khối lượng mol của hợp chất
- Bước đầu tiên trong việc tính công thức phân tử là xác định khối lượng mol. Để có thể tính toán khối lượng mol tổng của hợp chất, bạn phải xác định khối lượng mol của từng nguyên tố trong hợp chất.
Bước 2: Tính tỷ lệ giữa các nguyên tố
- Cách tính công thức phân tử sau khi xác định khối lượng mol của hợp chất, bạn cần tính tỷ lệ giữa các nguyên tố trong hợp chất dựa trên khối lượng mol của chúng. Tỷ lệ nguyên tố có thể được xác định bằng cách chia khối lượng mol của từng nguyên tố cho khối lượng mol tổng của hợp chất.
Bước 3: Xác định công thức phân tử
- Cuối cùng, bạn có thể xác định công thức phân tử dựa vào tỷ lệ nguyên tố. Để đưa tỷ lệ nguyên tố về dạng số nguyên, bạn phải nhân tất cả các tỷ lệ với một số nguyên phù hợp.
- Do đó, phương pháp tính công thức phân tử từ khối lượng mol là một phương pháp hữu ích và cần thiết cho những người học và làm việc trong ngành hóa học.

7. Những lỗi thường gặp khi tính công thức phân tử
Cách tính công thức phân tử có thể xảy ra khi tính công thức phân tử, do đó là rất quan trọng để biết các lỗi thường gặp.
Lỗi trong việc xác định khối lượng mol
- Một trong những lỗi phổ biến nhất là sai sót về khối lượng mol của các nguyên tố. Tính toán sai thường do nhiều người nhầm lẫn giữa các nguyên tố có khối lượng mol gần giống nhau.
- Để tránh lỗi này, hãy luôn kiểm tra kỹ bảng tuần hoàn và ghi nhớ khối lượng mol chuẩn của các nguyên tố thường gặp.
Lỗi trong việc tính tỷ lệ nguyên tố
- Cách tính công thức phân tử sai sót trong việc tính toán tỷ lệ giữa các nguyên tố là một lỗi khác thường xảy ra. Khi chia khối lượng mol của từng nguyên tố cho khối lượng mol tổng của hợp chất, nhiều học sinh dễ bị nhầm lẫn.
- Để khắc phục lỗi này, bạn nên thực hiện quy trình tính toán nghiêm ngặt và kiểm tra lại các phép toán của mình nhiều lần trước khi đưa ra kết luận.
Lỗi trong việc viết công thức phân tử
- Cuối cùng, viết sai công thức phân tử là một lỗi phổ biến khác. Kết quả có thể hoàn toàn sai nếu không tuân thủ quy tắc viết công thức hoặc nhầm lẫn số lượng nguyên tử.
- Để giảm thiểu khả năng mắc lỗi này, bạn nên tập viết công thức phân tử và tham khảo tài liệu hướng dẫn.
8. Kết luận
Việc tính toán các công thức phân tử là một kỹ năng cần thiết trong hóa học và mở ra nhiều cơ hội để nghiên cứu và sử dụng trong công việc. Bài viết này đã cho bạn một cái nhìn tổng quan về các bước cần thiết để tính toán công thức phân tử, các phương pháp sử dụng và những lỗi thường xảy ra khi thực hiện quy trình này.
Công thức phân tử được xác định dựa trên khối lượng mol và tỷ lệ phần trăm khối lượng nguyên tố hợp lý trong chất, từ đó cung cấp thông tin quan trọng về cấu trúc và thành phần hóa học. Việc hiểu quy trình này không chỉ hỗ trợ nghiên cứu trong hóa học mà còn góp phần vào các lĩnh vực như phát triển thuốc, giá như thuốc điều trị bệnh phong , chi tiết xin truy cập website:congthuccapsonhan.com xin cảm ơn!

